Calor específico o "capacidad calorífica"
específica de una sustancia es la "cantidad de calor necesaria para aumentar
su temperatura en una unidad por unidad de masa, sin cambio de estado". Su
unidad es el julio por kilogramo y kelvin, cuya notación es J/(kg·K).
Calor latente o "calor de cambio de estado" es la
energía absorbida por las sustancias al cambiar de estado, de sólido a líquido
(calor latente de fusión) o de líquido a gaseoso (calor latente de
vaporización). Al cambiar de gaseoso a líquido y de líquido a sólido se
devuelve la misma cantidad de energía. Se debe tener en cuenta que esta energía
en forma de calor se invierte para el cambio de fase y no para un aumento de la
temperatura.
Se define la caloría como la cantidad de energía calorífica
necesaria para elevar la temperatura de un gramo de agua pura en un grado
(desde 14,5 °C a 15,5 °C), a una presión normal de una atmósfera. Una caloría
(cal) equivale a 4,1868 julios (J).
Equivalencia entre el Julio y la caloría:
Equivalencia entre el Julio y la caloría:
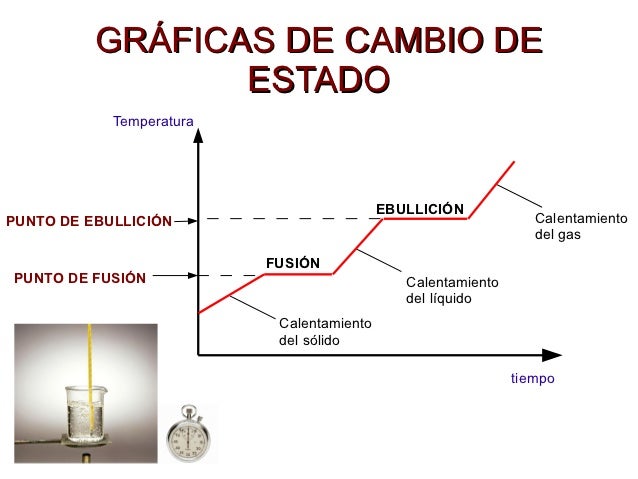
Para el calentamiento (aumento de temperatura sin cambio de
estado) utilizamos la ecuación (1) con el calor específico (Ce). Y para el
cambio de estado (que se produce a temperatura constante) utilizamos la
ecuación (2) con el calor latente de fusión (Lfusión) o el de ebullición (Lvap)
según que caso.


