Evidencia de las reacciones químicas
CAMBIO FÍSICO: Es aquel que ocurre externamente. No existe
un cambio interno en la estructura de la materia, ya que no existe una
reordenación de átomos; no se forman sustancias nuevas. Es un cambio de estado,
por tanto es reversible. La composición química de una sustancia permanece constante.
Ejemplo: los cambios de estado (Fundir hielo, vaporización...)
CAMBIO QUÍMICO: Cambio que ocurre internamente. En él existe
una reordenación de átomos dando origen a sustancias nuevas. Este cambio es el
resultado de una reacción química: generalmente es irreversible. La composición
química de una sustancia cambia. Ejemplo: Oxidación del hierro
REACCIÓN QUÍMICA, cambio químico o fenómeno químico, es todo
proceso termodinámico en el cual una o más sustancias (llamadas reactantes),
por efecto de un factor energético, se transforman, cambiando su estructura
molecular y sus enlaces, en otras sustancias llamadas productos.
Un cambio químico se lleva a cabo cuando:
- Se produce un gas.
- Se produce un sólido insoluble.
- Se observa un cambio de color permanentemente.
- Se observa un cambio de calor.
- Exotérmico – se libera calor.
- Endotérmico – se absorbe calor.
- Endotérmico – se absorbe calor.
ECUACIÓN QUÍMICA: descripción simbólica de una reacción
química. Muestra las sustancias que reaccionan (llamadas reactivos o
reactantes) y las sustancias que se obtienen (llamadas productos). También
indican las cantidades relativas de las sustancias que intervienen en la
reacción.
- La flecha: indica produce.
- Catalizador – sustancia que acelera la velocidad de reacción sin consumirse o alterarse permamentemente.
- Coeficientes: son los números a la derecha de la fórmula.
- Subíndice: son los números pequeños que indican el número de átomos de cada clase que hay en la fórmula química.
Estado Físico
El estado
físico se indica de la siguiente manera:
- (g) gas
- (l) líquido
- (s) sólido
- (ac) acuoso
Ley de conservación de la masa (Antoine-Laurent de Lavoisier (1743-1794)): La masa total de todas las sustancias presentes es la misma antes y después de llevarse a cabo la reacción química.
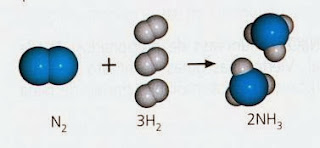
¿Qué
significa esta ecuación? N2 (g) + 3H2 (g) ® 2NH3 (g)
- 1 molécula de nitrógeno (con 2 átomos) reacciona con 3 moléculas de hidrógeno (con 2 átomos) para formar: 2 moléculas de amóníaco ( Cada molécula contiene 1 átomo de N y 3 átomos de H)
- 1 mol de nitrógeno (N2) reacciona con 3 moles de hidrógeno (H2) para formar: 2 moles de amoníaco (NH3)
- 28 gramos de nitrogeno reaccionan con 6 gramos de hidrogeno para formar: 34 gramos de amoniaco.
Algunos Tipos de reacciones químicas y ejemplo:
Reacción de Combinación (Síntesis): A
+ Z ® AZ
2Sr(s) + O2(g) ® 2SrO(s)
Reacción de Descomposición
(Análisis): AZ ® A + Z
Cd(HCO3)2(s) ® CdCO3(s) + H2(g) + CO2(g)
Reacción de Simple Desplazamiento: A
+ BZ ® AZ + B
Zn(s) + CuSO4(ac) ® ZnSO4(ac) + Cu(s)
Reacción de Doble Desplazamiento: AX
+ BZ ® AZ + BX
AgNO3(ac) + KCl(ac) ® AgCl(s) + KNO3(ac)
Siete elementos existen naturalmente como moléculas diatómicas:
H2, N2, O2, F2, Cl2, Br2, y I2
Representación molecular:
Combustión del metano:
Descomposición clorato potásico:
Síntesis del ácido clorhídrico: